Аннотация:
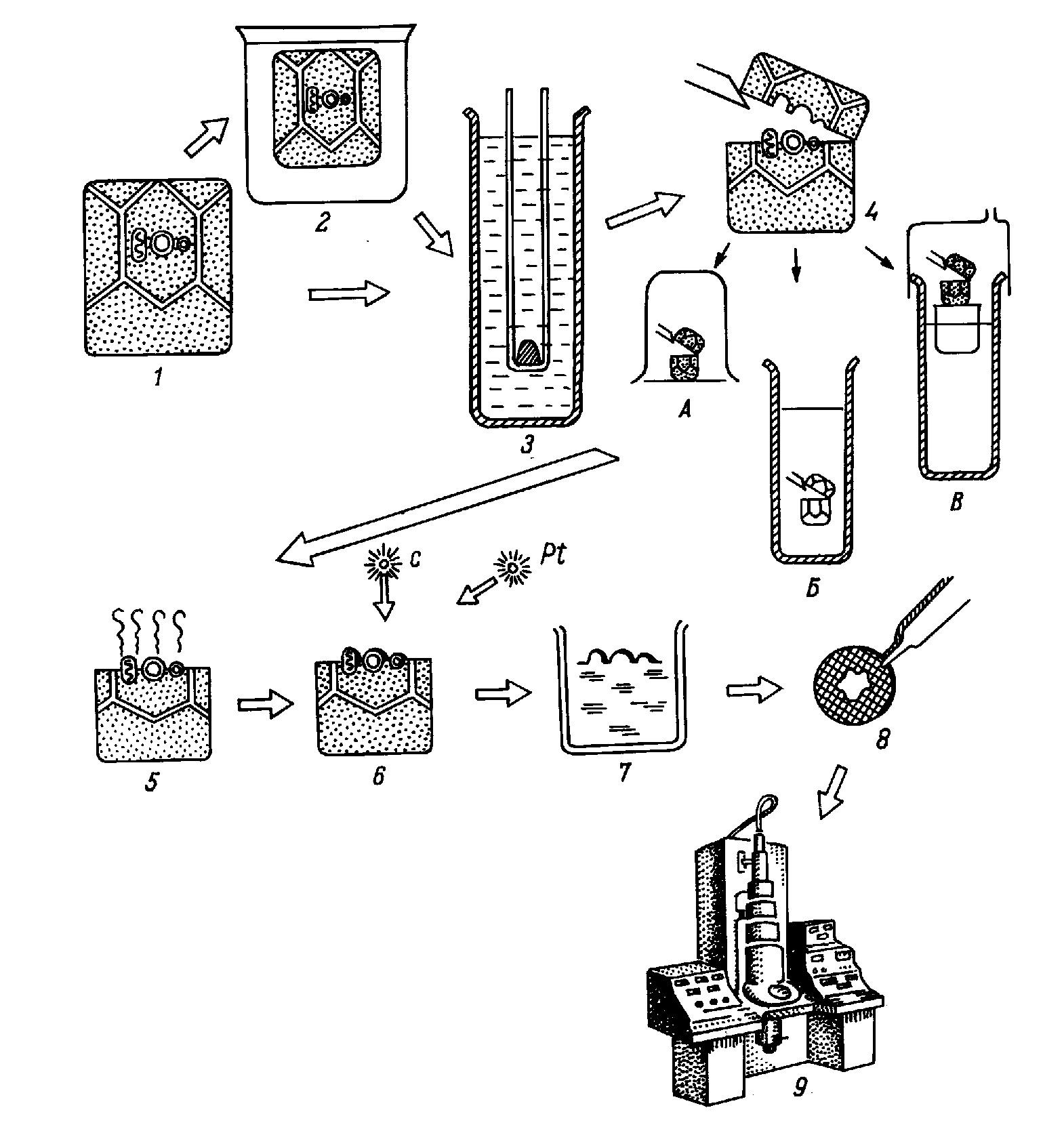
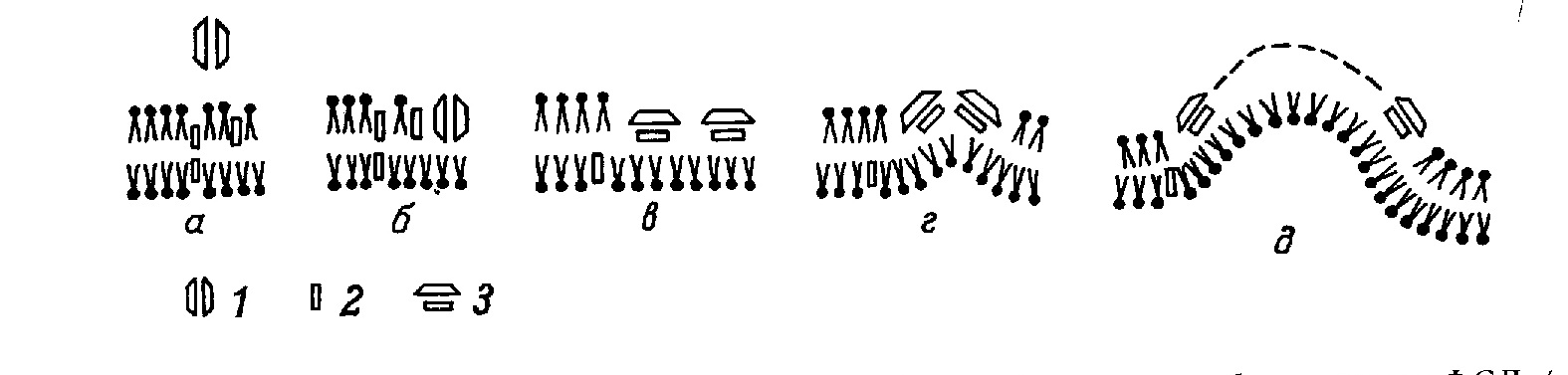
Монография является первым (и по сей день единственным) отечественным руководством по анализу ультраструктуры клеток и тканей животных методом замораживания-скалывания-травления. В ней рассматриваются физические основы метода, препаративные аспекты и результаты его применения в цитологии и гистологии. В книге детально разбираются артефакты метода и вопросы интерпретации изобраќжений с реплик замороженных и сколотых тканей и клеток. Большое место уделяется использоќванию метода замораживания-скалывания-травления в изучении биологических мембран, межклеточных контактов и внутриклеточных органоидов. Анализируются также перестройки основных клеточных элементов в процессе их функционирования и при воздействии различных агентов на клетку. Богатый иллюстративный материал книги является в большой степени оригиќнальным. Монография рассчитана на цитологов, гистологов, биологов, а также на преподавателей, аспирантов и студентов, изучающих цитологию и гистологию. Библиогр. 552 назв. Ил. 13+32 вклейќки. Табл. 1. Полную версию с электронограммами можно скачать здаесь: ttps://yadi.sk/i/iTeNMxsO3Erq6y
|